Schutzmantel aus Fresszellen
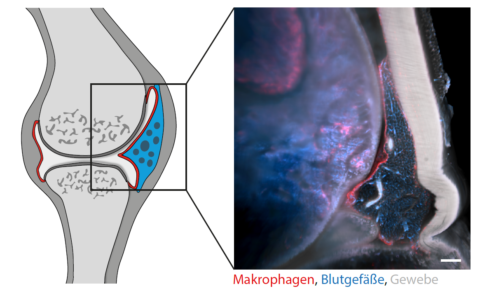
Makrophagen bilden Barrieren in Gelenken
Ein Forschungsteam der FAU hat entdeckt, dass Fresszellen des Immunsystems, sogenannte Makrophagen, geschlossene Barrieren bilden können und Gelenke so vor Entzündungen schützen. Bislang standen Makrophagen im Verdacht, für entzündliche Autoimmunerkrankungen wie rheumatoide Arthritis mitverantwortlich zu sein. Möglich wurde diese Entdeckung durch ein neuartiges bildgebendes Verfahren, mit dem Gelenke transparent gemacht und räumlich dargestellt werden können. Die Ergebnisse wurden im renommierten Fachjournal „Nature“ veröffentlicht.
Makrophagen sind wichtige Elemente unseres Immunsystems, die sich normalerweise aus im Knochenmark gebildeten weißen Blutkörperchen, sogenannten Monozyten, im Gewebe entwickeln. Dort spüren diese Zellen körperfremde Strukturen, etwa Krankheitserreger, auf und machen sie unschädlich. Bei chronisch-entzündlichen Autoimmunerkrankungen wie rheumatoider Arthritis oder multipler Sklerose werden Makrophagen jedoch fehlgesteuert und greifen körpereigene Zellen an – Entzündungen und die Zerstörung von Organen sind die Folge. Wann es zu solchen Autoimmunreaktionen kommt und welche Zellen daran beteiligt sind, ist jedoch nicht vollständig erforscht. Einem Forschungsteam von der Medizinischen Klinik 3 – Rheumatologie und Immunologie des Uni-Klinikums Erlangen der FAU ist es nun gelungen, die grundlegenden Mechanismen besser zu verstehen.
Tausende Zellen untersucht
In einem ersten Schritt haben die Forscherinnen und Forscher untersucht, welche Arten von Fresszellen im Gelenk vorkommen und welche Funktion sie eigentlich haben. „Um das herauszufinden, haben wir die globale Genexpression der Makrophagen auf Einzelzellebene analysiert. Das ist ein relativ neues und zugleich aufwändiges Verfahren“, erklärt Prof. Dr. Gerhard Krönke, Leiter der Professur für Translationale Immunologie. Bis zu 10.000 Zellen pro Gelenk hat die Arbeitsgruppe unter die Lupe genommen. „Durch die Analyse der Genexpressionsprofile konnten wir verschiedene Arten von Makrophagen mit stark divergierenden Aufgaben identifizieren“, sagt Krönke. „Unter anderem haben wir eine Unterart gefunden, die nicht aus im Knochenmark gebildeten Blutmonozyten entsteht, sondern dauerhaft im Gewebe angesiedelt ist und sich dort vermehrt. Diese residenten Makrophagen weisen im Gelenk enge Zellverbindungen untereinander auf, sie sind regelrecht miteinander verschränkt.“
Transparentes Gelenk in 3D
Wie genau diese Verbindungen aussehen, sollte ein neuartiges bildgebendes Verfahren zeigen, das Dr. Annika Grüneboom entwickelt hat. Mit Zimtsäureethylester – einer Flüssigkeit, die eigentlich als Aroma für Weihnachtsgebäck verwendet wird –, werden die Gelenke zunächst transparent gemacht. Anschließend werden die Proben unter einem Lichtblattmikroskop scheibchenweise durchleuchtet. „Man muss sich das vorstellen wie bei einem CT, nur dass in unserem Fall keine Röntgenstrahlung, sondern ein Laser zum Einsatz kommt“, sagt Annika Grüneboom. Mit einem speziellen Computerprogramm werden die aufgenommenen Abschnitte zu einem dreidimensionalen Modell zusammengesetzt. Das Team nutzt außerdem einen besonderen Effekt des Laserlichts: Es durchdringt nicht nur das Gelenk, es regt auch die Fluoreszenzproteine zum Leuchten an. Durch die Analyse von sogenannten Reporter-Mauslinien mit unterschiedlichen Fluoreszenzproteinen in Makrophagen konnten auf diese Weise die verschiedenen Arten der Fresszellen im 3D-Bild identifiziert werden.
Membran aus Makrophagen entdeckt
Was das Forscherteam in der rekonstruierten Aufnahme sah, war nicht nur unerwartet, sondern auch völlig verblüffend: Entlang der Gelenkinnenhaut, der sogenannten Synovialmembran, fand sich ein geschlossener Mantel aus residenten Makrophagen, der das Gelenk vom umliegenden Gewebe isoliert. „Die schrankenartigen Verbindungen ähneln stark der Epithelschicht im Darm“, erklärt Gerhard Krönke. Molekulare Analysen zeigten, dass sich diese Barriere aus Makrophagen ständig selbst erneuert. In weiteren Experimenten konnten die Wissenschaftler nachweisen, dass dieser Schutzmantel bei entzündeten Gelenken beschädigt ist oder gar fehlt. Krönke: „Bisher ist man davon ausgegangen, dass Makrophagen zu rheumatoider Arthritis beitragen. Jetzt wissen wir, dass sie Entzündungsreaktionen eindämmen können.“
Neue Therapieansätze
Die Erkenntnisse des FAU-Teams könnten neue Therapieansätze bei Autoimmunerkrankungen begründen. Aktuell werden Medikamente entwickelt, die fehlgesteuerte Fresszellen bei Entzündungen bekämpfen sollen – genau diese Medikamente können jedoch die Schutzmembran aus residenten Makrophagen zerstören. Interessant ist die Entdeckung auch für die Krebsforschung: Die Arbeitsgruppe vermutet, dass Makrophagen Tumore ebenso einhüllen und schützen wie Gelenke – bei Krebs jedoch ein unerwünschter Effekt. „Makrophagen können Leben retten, sie können Leben aber auch zerstören“, sagt Gerhard Krönke. „Es liegt noch viel Forschungsarbeit vor uns.“
Die Untersuchungen und Experimente, die zur Entdeckung der Makrophagenmembran im Kniegelenk führten, erfolgten im Rahmen der DFG-Forschungsgruppe FOR2886 PANDORA (Pathways triggering Autoimmunity and Defining Onset of early Reumatoid Arthritis) und des DFG-Sonderforschungsbereichs SFB1181 „Schaltstellen zur Auflösung von Entzündung“. Sowohl FOR2886 als auch SFB1181 wurden an der Medizinischen Klinik 3 – Rheumatologie und Immunologie des Uni-Klinikums Erlangen eingerichtet.
Weitere Informationen
Prof. Dr. Gerhard Krönke
Tel.: 09131/85-34742
gerhard.kroenke@uk-erlangen.de