Rheuma einen Riegel vorschieben?
Interdisziplinäres Forschungsteam entschlüsselt Mechanismus zur Hemmung von Gelenkentzündungen
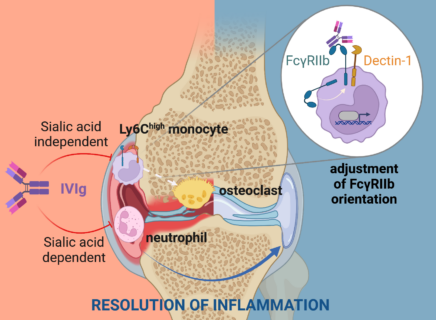
Immunoglobulin G-Antikörper (IgG) spielen bei infektiösen und Autoimmunerkrankungen eine wichtige Rolle als Entzündungstreiber. Gewinnt man jedoch dieselben Immunglobuline aus dem Blutplasma gesunder Spender, zeigen sie – gereinigt und in die Blutbahn injiziert – eine entzündungshemmende und das Immunsystem positiv beeinflussende Wirkung. Warum das so ist, war bisher weitgehend unklar. Ein interdisziplinäres Forschungsteam der FAU sowie der Universitäten Ulm und Würzburg unter der Führung von Prof. Falk Nimmerjahn, Lehrstuhl für Genetik der FAU, hat nun den Mechanismus entschlüsselt, durch den IVIg die Auflösung von Gelenkentzündungen bei rheumatoider Arthritis vermittelt. Ihre Erkenntnisse haben die Forschenden im Fachjournal Immunity veröffentlicht (DOI: 10.1016/j.immuni.2023.02.019).
Die Ergebnisse zeigen, dass die Antikörper aus gesunden Spendern – auch als intravenöse Immunglobuline, kurz IVIg, bezeichnet – in der Lage sind, einen zentralen selbstzerstörerischen Prozess im Rahmen der rheumatoiden Arthritis zu unterdrücken: den Ab- und Umbau von Knochen und Knorpelgewebe im Gelenk. „Dieser durch die Entzündungsreaktion auftretende Knochenabbau führt sonst bei Patienten zu einer schweren Schädigung der Gelenke,“ erklärt Prof. Nimmerjahn. „Die Ergebnisse der Studie zeigen jetzt erstmals, wie dieser Prozess auf molekularer Ebene durch Antikörper unterdrückt wird.“ Überraschend war für das interdisziplinäre Forschungsteam vor allem, dass Moleküle, die eigentlich mit der Abwehr von Erregern wie Bakterien und Pilzen in Verbindung gebracht werden, eine zentrale Rolle für die entzündungshemmende Wirkung von intravenösen Immunglobulinen spielen. In der Tat kam es in Abwesenheit dieser Rezeptoren zu einem Verlust der knochenschützenden und entzündungshemmenden Wirkung der Antikörper. Diese Erkenntnisse sind von großer Bedeutung für die Entwicklung neuer Therapien bei Autoimmunerkrankungen und Entzündungen, die durch Zytokine und Autoantikörper ausgelöst werden.
Essenziell für diese interdisziplinäre Studie war die Zusammenarbeit mit führenden Experten in der atomistischen Simulation von Rezeptoren und Zellmembranen (Prof. Rainer Böckmann, FAU), die von dem optimalen Umfeld des Zentrums für Nationales Hochleistungsrechnen Erlangen (NHR@FAU) profitierten. Ebenso wichtig war die Zusammenarbeit mit weltweit führenden Wissenschaftlern auf dem Gebiet der hochauflösenden Mikroskopie (Super-Resolution-Mikroskopie) um Prof. Markus Sauer (Universität Würzburg). Die Forschungsarbeiten wurden im Rahmen des Forschungsverbundes CRC1181 (Auflösung von Entzündungsprozessen; Sprecher: Prof. Georg Schett, FAU), gefördert durch die Deutsche Forschungsgemeinschaft, durchgeführt.
Weitere Informationen:
Prof. Dr. Falk Nimmerjahn
Lehrstuhl für Genetik
falk.nimmerjahn@fau.de